- home
- 研究内容
研究内容
当研究室では、分子を動きと共に視ることを念頭に、以下の研究に取り組んでいます。
1. X線自由電子レーザーを用いたタンパク質時間分割結晶学研究
X線結晶構造解析は、精密な分子構造を決定できる最も優れた方法ですが、以下のような欠点があります。 まず、1)適切な結晶がなければ実行できないという深刻な欠点があげられます。 また、2)解析から得られる立体構造は、いわゆる静止状態の構造であるため、溶液状態で作用している動く状態のタンパク質の姿を反映していません。 さらに、3)X線照射による結晶の損傷と熱振動による測定データの悪化を抑えるために、液体窒素温度に冷やして測定を行うため、得られた構造が常温とは異なる可能性があります。
近年、この問題を打開すると期待される新たな技術革新が起きました。 2010年、米国LCLS (Linac Coherent Light Source at Stanford University)でX線自由電子レーザー(X-ray free electron laser; XFEL)の使用が可能となり、我が国でも、2012年に世界で2番目の施設としてSACLA (SPring-8 Angstrom Compact Free Electron Laser) が利用可能となったことです。 これらXFELは、例えばSACLAはSPring-8の10億倍輝度という桁違いに高輝度でコヒーレントなフェムト秒パルスX線を発生します。 このXFELを用いれば、これまで不可能だったマイクロメートル以下のサイズの微小な結晶でも解析が可能となります。しかも測定時間がフェムト秒に短縮されることで、寿命の短い状態の立体構造を常温で捉えることができ、動作中のタンパク質の動きを原子レベルで解析することが可能となると考えられるからです。さらに XFELでは非常に面白い現象が起こります。XFELの高エネルギーX線が衝突すると結晶が破壊されますが、その破壊される時間よりも早くX線回折測定を終了できてしまうのです。これを「diffraction before destruction concept」( Science 316 1444 (2007))といい、無損傷の回折強度データの収集が室温で可能になると期待されます。 その結果、微結晶混合液を流した状態にフェムト秒パルスX線を連続的に照射して測定する「serial femto-second X-ray crystallography (SFX)」がlysozyme微結晶で実現しました( Nature 505 244 (2014)。
我々は、SFXをSACLAの特徴を生かして改良応用し、構造未知の酵素の立体構造決定に世界で初めて成功しました(1-1)。 実際に得られた電子密度図は、従来法(単一結晶を用い液体窒素温度で測定)で得られた場合に比べ遥かに鮮明です。
- (1-1) Yamashita K. Pan D. Okuda T. Sugahara M. Kodan A. Yamaguchi T. Murai T. Gomi K. Kajiyama N. Mizohata E. Suzuki M. Nango E. Tono K. Joti Y. Kameshima T. Park J. Song C. Hatsui T. Yabashi M. Iwata S. Kato H. Ago H. Yamamoto M. Nakatsu T. (2015) An isomorphous replacement method for efficient de novo phasing for serial femtosecond crystallography. Sci Rep. 5 14017.
2. 発光酵素反応の構造生物学研究
ホタルの発光でよく知られている生物発光現象は発光基質と発光酵素による反応で、一般にはルシフェリンールシフェラーゼ反応と呼ばれており、非常に興味深く明らかになっていない性質がたくさんあります。
(a)発光基質は同じであるにも関わらず、発光を手助けするタンパク質のわずか1アミノ酸を変化させると発光色が変化すること。
(b)発光は酸化反応によって生じ、その際の発光量子収率(生じた化学反応の内、光を出す反応の割合)が、ホタルの発光量子収率0.41(2-1)を筆頭に多くの生物発光反応の量子収率が、その他の発光反応に比べて量子収率が高いということ。
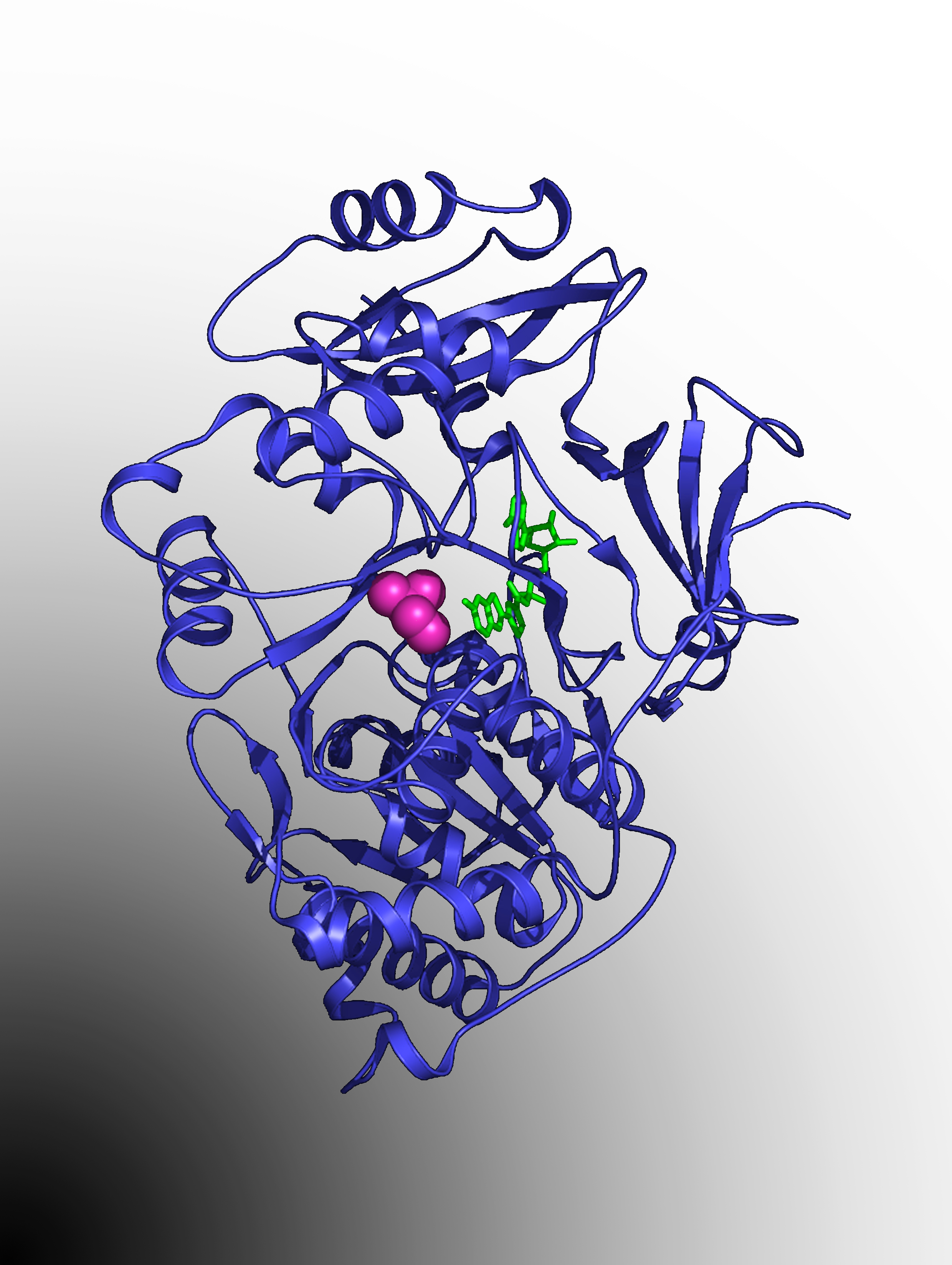
です。(a)の発光色変化についてはについては、ホタルルシフェラーゼと発光直前を模した反応中間体アナログDLSAとの複合体のX線結晶構造解析から、発光が生じるときのルシフェラーゼと発光体である励起状態のオキシルシフェリンの相補性が、発光色を決定するために重要であることを世界で初めて報告しました(2-2)。(b)の発光量子収率については、発光色と発光量子収率、そしてルシフェラーゼの構造との関係がどのようになっているのかを初めて明らかにすることができました(2-3)。
生物発光現象を示すタンパク質は緑色蛍光タンパク質GFPがノーベル賞の対象となり一躍有名になりました。GFPは蛍光タンパク質でイメージングによく利用されています。最近では発光も多く用いられるようになり、ガウシアルシフェラーゼによるインシュリンの分泌の様子(2-4)や、ホタルルシフェラーゼを用いた動物個体のバイオイメージング(2-5)への応用がなされています。このような応用への展開を進めていくためにも、発光現象の基本をタンパク質の立体構造を基に理解することが大変重要です。 そこで我々はホタルの発光酵素ルシフェラーゼのみならず、オワンクラゲの発光タンパク質イクオリン、エビの発光酵素ルシフェラーゼ、などにも対象を広げながら、研究を進めています。そして、詳細な発光反応を明らかにすることを目的にSACLAを用いたSFX実験を開始しています。
- (2-1) Ando Y et al (2008) Firefly bioluminescence quantum yield and colour change by pH-sensitive green emission. Nature Photo 244-47.
- (2-2) Nakatsu T Ichiyama S Hiratake J Saldanha A Kobashi N Sakata K Kato H. (2006) Structural basis for the spectral difference in luciferase bioluminescence. Nature 440 372-376
- (2-3) Wang Y Akiyama H Terakado K Nakatsu T. (2013) Impact of site-directed mutant luciferase on quantitative green and orange/red emission intensities in firefly bioluminescence. Sci Rep 3 2490
- (2-4) Suzuki T et al. (2017) Quantitative visualization of synchronized insulin secretion from 3D-cultured cells. Biochem Biophys Res Commun. 486 886-892
- (2-5) Iwano S. et al. (2018) Single-cell bioluminescence imaging of deep tissue in freely moving animals. Science 359 935-939
3.膜電位感受性イオンチャネルの構造生物学研究
神経情報伝達において神経細胞内での情報の伝達は膜電位の脱分極によって行われる。膜電位は様々なイオンチャネルによって調節されるが、その中でも膜電位感受性ナトリウムチャネルは膜電位の速やかな脱分極をになう重要な膜蛋白質であり、変異による活性変化は様々な遺伝的疾患を引き起こす原因となる。よってこれらのチャネルの分子メカニズムを明らかにすることは神経情報伝達を分子レベルで理解するために非常に重要である。
高等生物のナトリウムチャネルは複雑で巨大な膜たんぱく質であり構造解析が困難な試料であるが、原核生物由来膜電位感受性ナトリウムチャネル(NaChBac)はホモ四量体構造で対称性が高く、精製試料の大量調整が可能であることから構造解析に適した試料である。
我々は様々な細菌由来の NaChBac の電気生理実験を行い、それぞれが高い一次配列の相同性を持ちながら宿主細菌の育成環境に応じたチャネル活性を有していることを見出した(Irie et al. J Biol.Chem., 2010)。以上のことから、結晶構造解析と電気生理学的手法を用いて NaChBac ホモログを機能解析することで、膜電位感受性ナトリウムチャネルが共通して持つイオン選択性や活性制御の分子機構の解明を目指して研究を進めている。
本学でのプレスリリース記事
令和5年7月31日(月)
多価陽イオンによってイオン電流が調節される仕組みを解明 ~思考や記憶等の元になる神経伝達の調節機構についての知見~
令和5年12月19日(火)
電位依存性Na+チャネルの意外な構造と分子間相互作用の発見!

